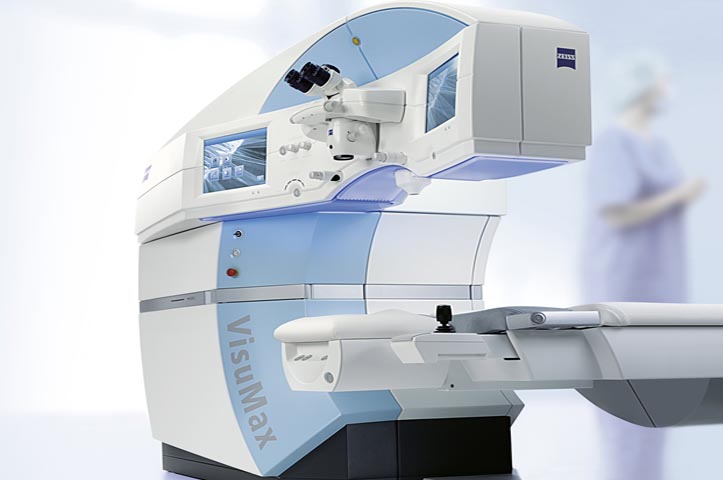
Badan Pengawas Obat dan Makanan, Amerika Serikat (FDA) baru saja menyetujui VisuMax femtosecond Laser, pabrikan Carl Zeiss Meditec, untuk menghilangkan jaringan kornea yang rusak, untuk mengurangi atau menghilangkan kondisi miopia pada dewasa diatas usia 22 tahun.
Melalui alat ini, penelitian bertajuk Small Incision Lenticule Extraction (SMILE) dilakukan oleh dokter. Laser dengan kecepatan yang cukup tinggi ini mengeluarkan cahaya, yang nantinya digunakan dokter mata untuk membuat sayatan kecil, menghilangkan jaringan yang rusak dan memperbaiki kembali kornea untuk mengoreksi pasien dengan miopia.
Hasilnya, 328 pasien yang ikut dalam penelitian SMILE selama 6 bulan, memperlihatkan perbaikan penglihatan dari kondisi miopia sebelumnya, sebesar 88%. Kita ketahui bahwa prosedur untuk menghilangkan kornea pasien dengan miopia, merupakan tindakan yang cukup sulit dikerjakan selama prosedur operasi dilakukan. Salah satu efek samping dari prosedur ini, termasuk adanya debris dilokasi ekstraksi jaringan, mata kering, hingga adanya lingkaran cahaya atau silau dengan derajat sedang hingga berat setelah prosedur dilakukan. Dengan alat baru ini diharapkan efek samping yang sering muncul dapat dikurangi.
Badan Obat dan Makanan Amerika Serikat (FDA) memberi persetujuan ustekinumab (Stelara, Janssen Biotech, Inc) untuk pengobatan penyakit Chron aktif moderat sampai berat, pada pasien berusia 18 tahun atau lebih.
Secara khusus, interleukin-12/23 inhibitor diindikasikan untuk pasien Crohn yang gagal atau tidak toleran terhadap terapi imunomodulator atau kortikosteroid, tapi tidak pernah gagal pengobatan dengan tumor necrosis factor (TNF) blocker atau yang gagal atau tidak toleran terhadap pengobatan dengan satu atau lebih TNF blocker.
Ustekinumab sudah disetujui di AS untuk pengobatan pasien dengan psoriasis plak dan arthritis psoriasis. “Penyakit Crohn adalah kondisi yang kompleks untuk diobati, dan tidak semua terapi bekerja untuk setiap pasien,” ujar William J. Sandborn, MD, Kepala Divisi Gastroenterologi dan Profesor di Universitas California, San Diego, pada rilisnya.
Persetujuan FDA atas ustekinumab adalah, “Satu kemajuan penting dalam pengobatan pasien dengan penyakit Crohn. Terapi ini menawarkan mekanisme kerja alternatif, untuk mengindukasi dan mempertahankan remisi klinis dari waktu ke waktu. Berdasarkan hasil program pengembangan klinis, Stelara memiliki potensi manfaat bagi semua orang dewasa dengan penyakit Crohn,” tambah Dr Sandborn, peneliti studi ustekinumab pada penyakit Crohn.
Program pengembangan klinis untuk ustekinumab pada penyakit Crohn, melibatkan lebih dari 1.300 pasien dari tiga penelitian fase 3 studi, yang menjadi dasar atas persetujuan FDA. Dalam penelitian-penelitian klinis pada pasien yang baru menjalani, pernah menjalani atau gagal terhadap terapi anti TNF, antara 34% dan 56% pasien mengalami pengurangan gejala dalam 6 minggu, setelah mendapat induksi ustekinumab. Perbaikan bisa dilihat dalam 3 minggu.
Sebagian besar pasien yang merespon dosis induksi dan yang melanjutkan pengobatan ustekinumab subkutan dengan dosis rumatan setiap 8 minggu, mengalami remisi di akhir minggu ke 44 (52 minggu dari inisiasi dosis induksi).